胰腺癌是一种恶性程度很高,诊断和治疗都很困难的消化道恶性肿瘤,约90%为起源于腺管上皮的导管腺癌。其发病率和死亡率近年来明显上升。5年生存率<1%,是预后最差的恶性肿瘤之一。m6A甲基化修饰是pri-miRNA加工和成熟的重要机制,但其异常调控在人类疾病中的作用尚不清楚。本研究作者发现,吸烟产生的香烟烟雾冷凝液(cigarette smoke condensate,CSC)能够通过m6A修饰诱导miR-25-3p前体成熟,从而促进胰腺癌的发生发展。

影响因子:12.353
实验方法:miRNA测序、m6A pri-miRNA测序、ChIP qPCR、RNA pull down
实验材料:CSC(香烟烟雾冷凝液),DMSO(普通化学溶解剂),胰腺导管腺癌细胞,胰腺细胞等
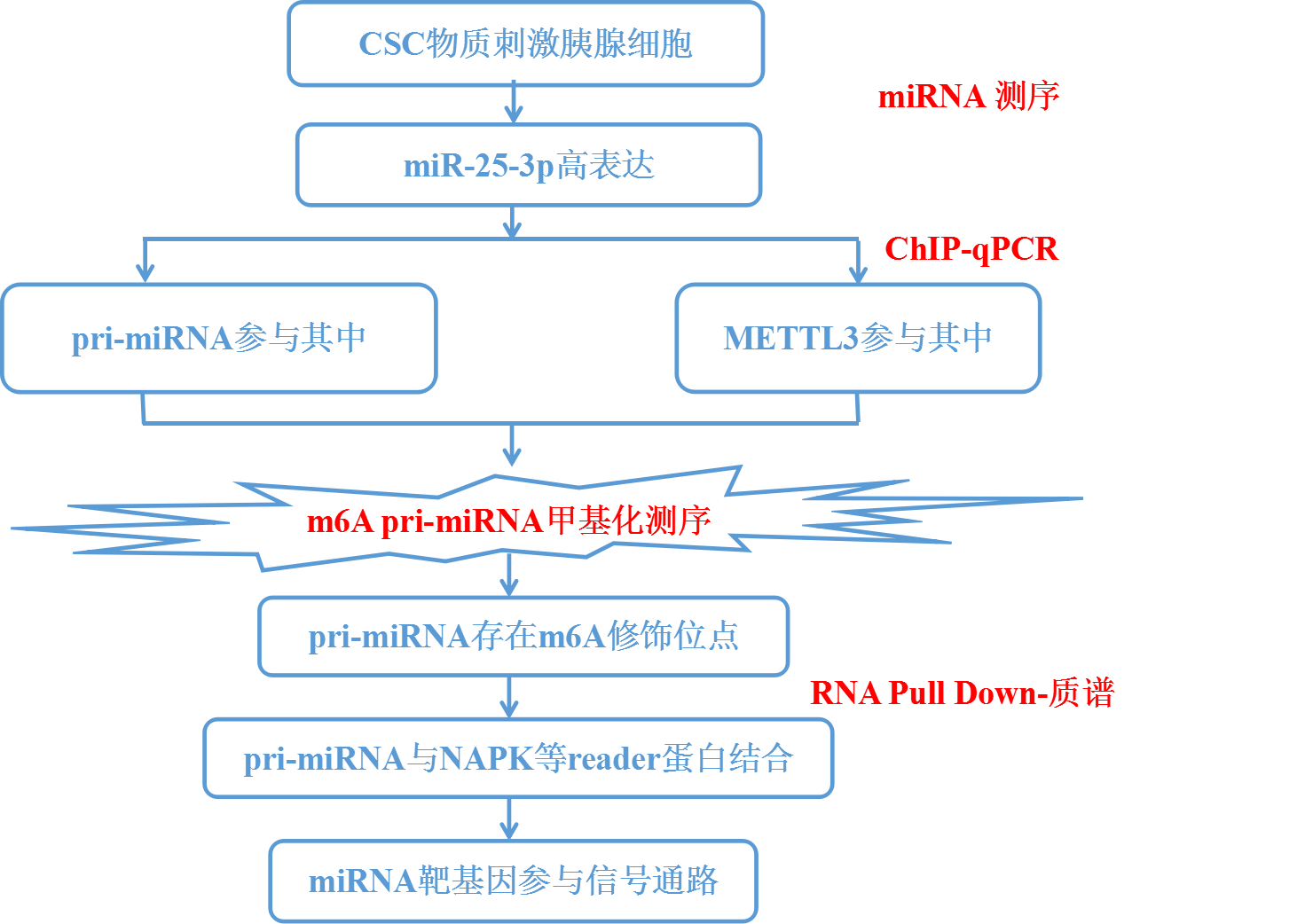
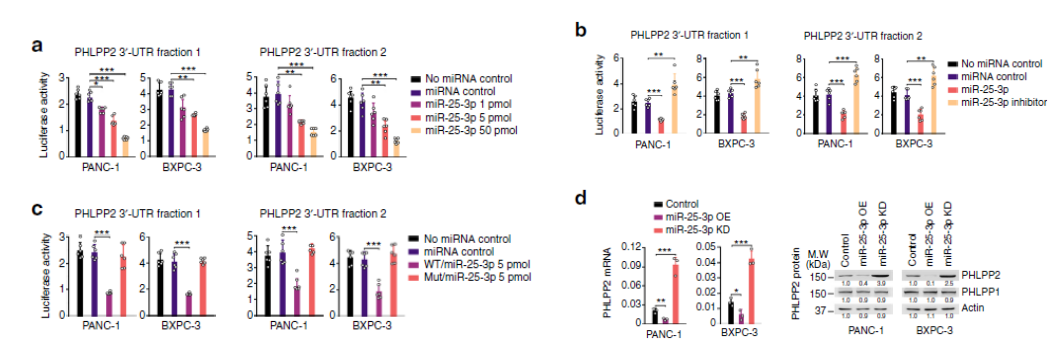
CSC处理胰管上皮细胞和未处理组分别进行miRNA测序(云序可提供此服务),筛选到实验组中差异高表达的miRNA----miR-25-3p。并且,miRNA的表达量对CSC浓度正相关。前面是细胞中的情况,接着作者检测了抽烟和不抽烟人群胰腺组织中miRNAs的表达水平,发现miR-25-3p在吸烟者中也是高表达的。在正常和胰腺癌细胞中,也发现miR-25-3p在癌细胞中显著上调。以上结果表明抽烟和PDAC疾病会导致miR-25-3p的表达量显著上调。接着作者又结合临床指标,发现miR-25-3p高表达的PDAC病人生存时间较短。同时,miR-25-3p与细胞增殖、迁移和侵袭表型相关。
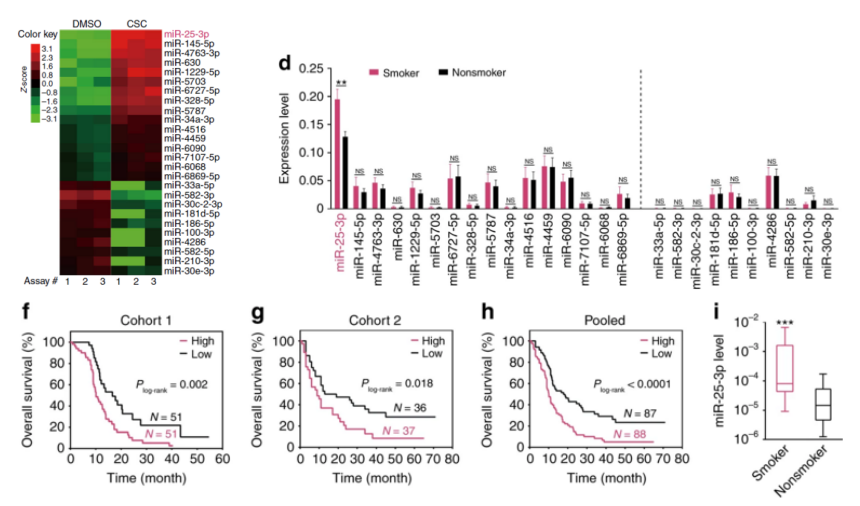
为进一步阐明CSC诱导miR-25-3p的分子机制,作者首先检测了CSC处理PDAC细胞时pri-miR-25、pre-miR-25和miR-25-3p的表达情况,发现CSC处理能够降低pri-miR-25表达同时增加pre-miR-25和miR-25-3p表达,暗示CSC可能通过调控pri-miR-25的加工和成熟来诱导miR-25-3p的高表达。由于m6A甲基化修饰在miRNA前体加工和成熟过程中起着重要的调控作用,作者检测了几个重要的m6A甲基化转移酶,查看这些酶是否会影响CSC诱导的miR-25-3p的表达,结果发现CSC会诱导METTL3高表达且呈现浓度依赖性,但对METTL14和WTAP表达无影响。随后,作者做进一步验证,发现在PDAC细胞中过表达METTL3酶,能够显著降低pri-miR-25水平,升高pre-miR-25和miR-25-3p水平,反之亦然。同时,敲减METTL3也显著降低CSC诱导的miR-25-3p表达。以上数据暗示,CSC可能通过提高METTL3的表达,进而促使miR-25-3p高表达。
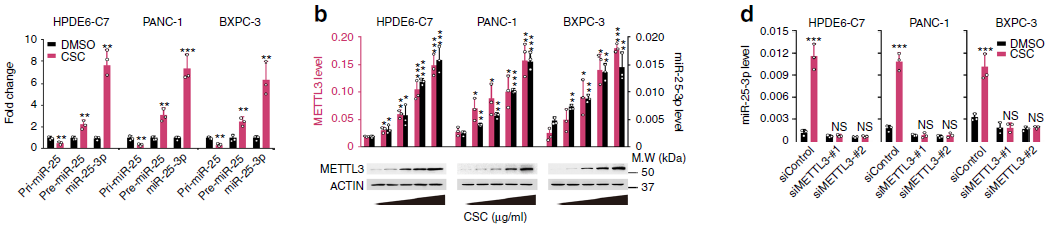
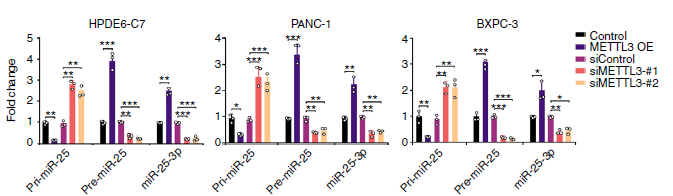
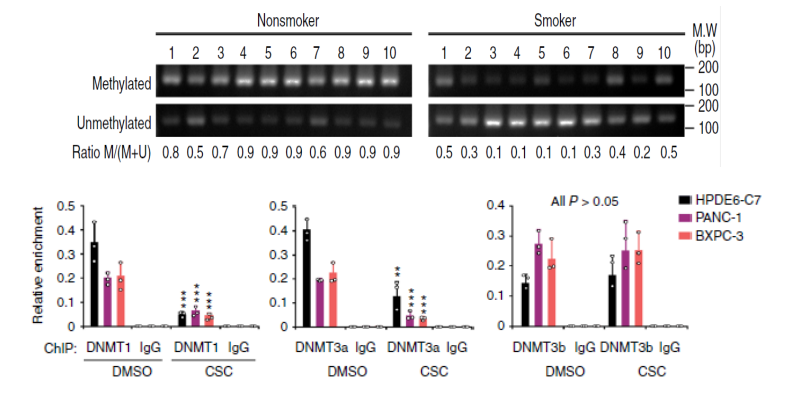
首先,作者通过DNA甲基化低通量验证技术(云序可提供此服务),证实CSC能够抑制MeTTL3基因启动子区域的甲基化程度。通过ChIP-qPCR(云序可提供此服务)实验,结果显示CSC处理能够降低DNA甲基化转移酶DNMT1和DNMT3a在METTL3启动子的结合。这种情况在吸烟者的胰腺组织中同样存在。接着作者通过生信分析确定了调控METTL3的4个潜在转录因子,但在肿瘤和非肿瘤的胰腺组织中只有NFIC这个转录因子与METTL3的mRNA表达水平呈正相关。为进一步验证,作者在PDAC细胞中敲减NFIC,发现METTL3和miR-25-3p的表达量显著降低。此外,吸烟者的非肿瘤胰腺组织中NFIC在METTL3启动子的结合同样显著增加。以上结果表明,CSC通过降低METTL3启动子区域的DNA甲基化,使其与转录因子NFIC结合,进而促进METTTL3的表达。
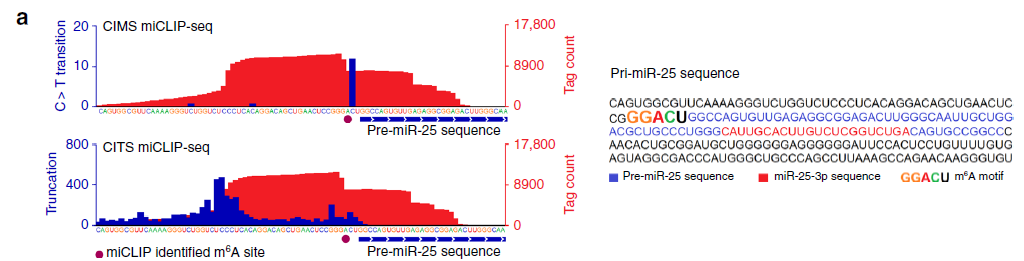
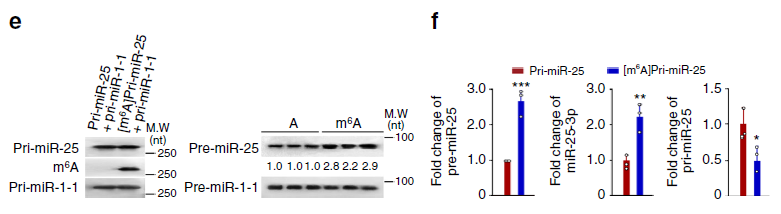
为进一步探索了METTL3是否影响miR-25-3p成熟,作者首先通过m6Apri-miRNA甲基化测序(云序可提供此服务)分析了pri-miR-25上的m6A位点,发现m6A的确存在于pri-miR-25剪切位点。MeRIP-qPCR(云序可提供此服务)分析显示,PDAC样本中pri-miR-25的m6A修饰比非PDAC样本要高很多。同样的,CSC处理增加细胞中pri-miR-25的m6A修饰;而过表达METTL3同样增加pri-miR-25的m6A修饰,敲减METTL3则相反。这些结果暗示METTL3在m6A的形成和miR-25-3p的成熟中发挥着重要作用。为检测m6A是否直接调控miR-25成熟,作者利用体外转录的含m6A的pri-miR-25([m6A]pri-miR-25)和不含m6A修饰的pri-miR-25进行了体外RNA成熟实验,结果显示,[m6A]pri-miR-25被剪切成的pre-miR-25显著增加;当pri-miR-25上METTL3结合区域发生突变后,pri-miR-25被剪切成的pre-miR-25显著降低。这些体外结果与细胞内相一致,提示吸烟者和PDAC病人中高表达的miR-25-3p可能是由于香烟刺激导致METTL3高表达,增加pri-miR-25上m6A修饰所致的。
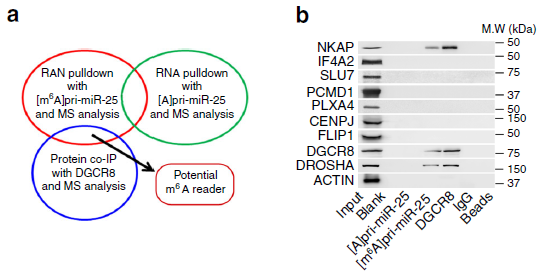
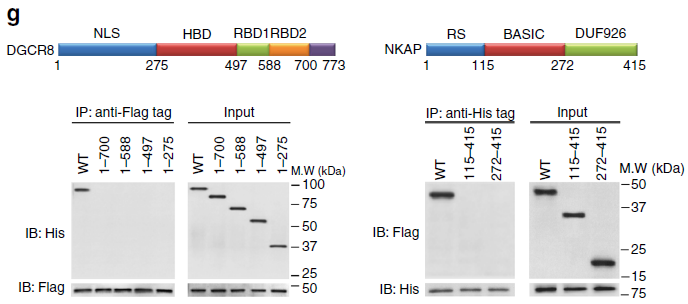
为找到pri-miRNA的reader酶,作者通过RNA Pull Down(云序可提供此服务)联合质谱,找到22个与pri-miRNA m6A结合的蛋白。DGCR8是pri-miR-25加工成熟过程中重要的酶,做coIP(云序可提供此服务)后发现有9个蛋白与DGCR8相互作用。两者取交集后发现NKAP,为pri-miR-25中m6A的识别蛋白。
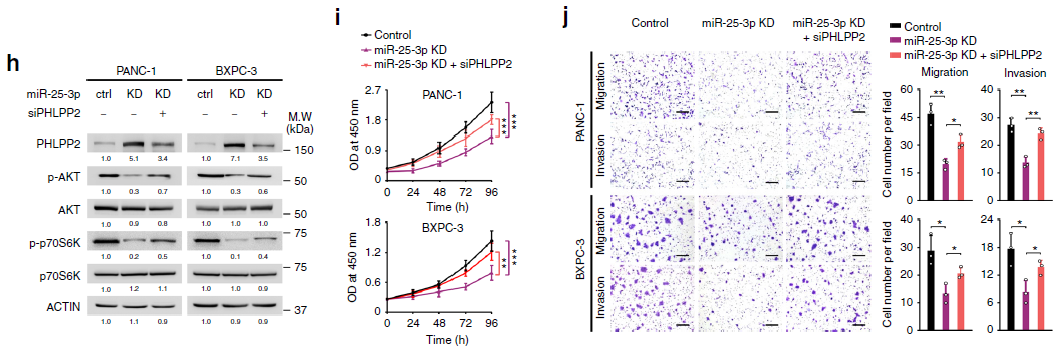
接下来,作者研究了miRNA与其靶基因的作用机制,借助生信分析预测了miR-25-3p的潜在靶基因PHLPP2。通过荧光素酶和过表达以及敲除实验证实PHLPP2确实是miR-25-3p的潜在靶基因。最后,对文章进行了升华,证实靶基因参与了AKT信号通路并影响p70S6K磷酸化水平。
总结
在本研究中,作者首先通过miRNA高通量测序手段,在CSC处理组中筛到表达最高的miR-25-3p,并在临床和功能上意义重大。
随后,作者兵分两路,深入挖掘miR-25-3p差异表达原因及其功能。
一方面:证实CSC诱导METTL3启动子低甲基化并通过转录因子NFIC使其表达升高,从而增加pri-miR-25的m6A甲基化程度;一方面:找到了pri-miR-25的m6A甲基化识别蛋白为NKAP,通过与miRNA成熟加工蛋白DGCR8和Drosha形成复合体促进pri-miR-25成熟为miR-25-3p;最后通过生信手段找到miR-25-3p的靶基因PHLPP2,证实其通过激活AKT癌症信号通路促进PDAC的发生和发展。
相关咨询
杨宝峰院士团队RNA修饰又一成果 | 云序ac4C acRIP-seq助力揭示心脏I/R损伤的作用机制 (2024-12-03T00:00 浏览数:14372)
杨宝峰院士团队最新成果 | 云序助力揭示RNA修饰m7G调控心肌肥厚的机制研究 (2024-11-13T00:00 浏览数:15862)
Nature子刊| 重磅综述!一文总结「m6A修饰非编码RNAs」在各类肿瘤中的调控机制及作用 (暂无发布时间 浏览数:12239)
研究速览-eccDNA 2023年最新进展大放送! (暂无发布时间 浏览数:14116)
云序生物MeRIP-qPCR技术干货 (暂无发布时间 浏览数:13897)
技术干货| “eccDNA碱基序列的获取及引物设计”方法教程 (暂无发布时间 浏览数:12831)
云序客户m6A高分文章|揭示组蛋白乙酰化与m6A修饰在眼部黑色素瘤发生中的共同作用机制 (暂无发布时间 浏览数:6972)
Nat Biotechnol IF=47 | BID-seq:一种基于单碱基分辨率的假尿嘧啶(Ψ)修饰定量测序检测方法 (暂无发布时间 浏览数:6950)
北大伊成器团队Nature Reviews重磅发文:非m6A热门修饰调控与功能一文速览! (暂无发布时间 浏览数:10906)
用户文章m6A专题|IF=9.8|m6A去甲基化酶ALKBH5缺乏会加重钴致神经退行性损伤 (暂无发布时间 浏览数:6912)
